
COLTAN
El coltan o coltán es una mezcla de los minerales columbita (una mena de columbio o niobio) y tantalita (una mena de Tantalio). El coltán es de color gris metálico oscuro.
APLICACIÓN
Se trata de un recurso estratégico imprescindible en la fabricación de componentes electrónicos avanzados. El tántalo se usa principalmente en la elaboración de condensadores. El condensador electrolítico de tántalo es, en la actualidad, un tipo bastante común de condensador presente en gran cantidad de dispositivos electrónicos, como en teléfonos móviles, computadoras, pantallas de plasma, cámaras digitales o equipos de alta tecnología como, por ejemplo, los satélites artificiales.
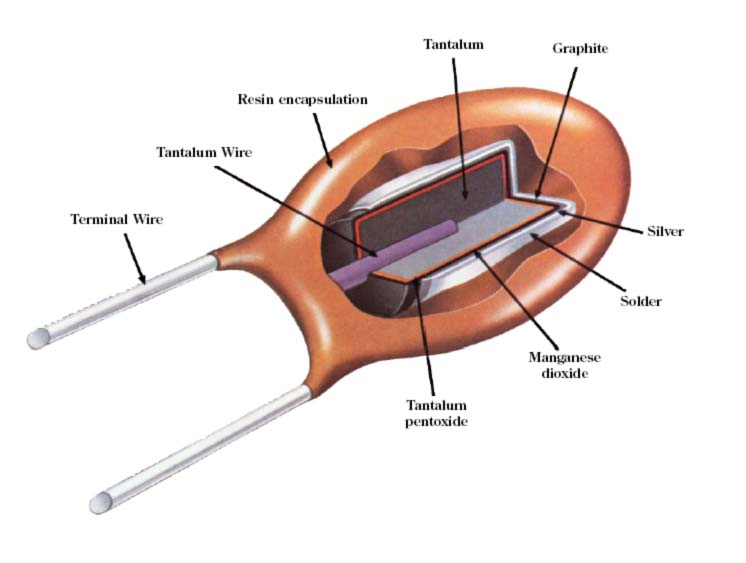 Estos dispositivos son cada vez más
pequeños, delgados y
fiables gracias, en gran parte, al uso de los condensadores
electrolíticos SMD de tántalo, que han ido sustituyendo a los
condensadores electrolíticos tradicionales. Aunque la mayoría de los
dispositivos electrónicos pueden funcionar con condensadores
electrolíticos normales, los condensadores electrolíticos de tántalo
tienen valores de capacidad eléctrica más exactos y, en especial, son
mucho más pequeños. Esto los hace ideales para las exigencias actuales
de miniaturización de los dispositivos electrónicos. La gran demanda de
estos condensadores ha elevado el precio del tántalo. Un condensador de
tántalo cuesta más que un condensador electrolítico normal de las mismas
características.
Estos dispositivos son cada vez más
pequeños, delgados y
fiables gracias, en gran parte, al uso de los condensadores
electrolíticos SMD de tántalo, que han ido sustituyendo a los
condensadores electrolíticos tradicionales. Aunque la mayoría de los
dispositivos electrónicos pueden funcionar con condensadores
electrolíticos normales, los condensadores electrolíticos de tántalo
tienen valores de capacidad eléctrica más exactos y, en especial, son
mucho más pequeños. Esto los hace ideales para las exigencias actuales
de miniaturización de los dispositivos electrónicos. La gran demanda de
estos condensadores ha elevado el precio del tántalo. Un condensador de
tántalo cuesta más que un condensador electrolítico normal de las mismas
características.
Otro campo de aplicación interesante de este metal es el de las comunicaciones ópticas. El niobato de litio (LiNbO3) se usa en guías de onda, moduladores y conmutadores optoelectrónicos o láseres. Este compuesto es clave para poder elaborar redes de fibra óptica más rápidas y eficientes, y así, entre otras cosas, poder disfrutar de conexiones más rápidas a Internet.
COMPOSICIÓN QUÍMICA
La columbita está compuesta por óxidos de niobio, hierro y manganeso [(Fe, Mn) Nb2O6], y la tantalita está compuesta por óxido de tántalo, hierro y manganeso [(Fe, Mn) Ta2O6] en cualquier proporción. Estos óxidos constituyen una solución sólida en ambos minerales. Son escasos en la naturaleza y dan un claro ejemplo de materiales que han pasado de ser considerados simples curiosidades mineralógicas a cruciales para el avance tecnológico debido a sus nuevas aplicaciones.
La columbita y la tantalita son muy similares, con un aspecto oscuro y veteado. En realidad, podríamos decir que se trata del mismo mineral, con la fórmula [(Fe,Mn)(Nb,Ta)2O6]. Si predomina el niobio frente al tantalio tenemos columbita (más ligera), y si predomina el tantalio (en cuyo caso, siendo estrictos, la fórmula sería [(Fe, Mn)(Ta, Nb)2O6]) tenemos la tantalita, que es más densa. El coltán es el nombre genérico que recibe la mezcla de ambas.
Tantalio
El interés de la explotación del coltán es fundamentalmente poder extraer el tantalio (símbolo químico Ta). Es un metal de transición muy resistente a la corrosión e inerte, por lo cual es
muy valorado como sustituto del platino en la instrumentación. Sin embargo su ‘boom’ llegó con la telefonía móvil. Los condensadores electrolíticos de tantalio son totalmente análogos a los más habituales de aluminio, por ejemplo. Sin embargo, con el tantalio podemos conseguir una mayor capacidad con un menor tamaño. Como los condensadores son vitales en cualquier dispositivo electrónico, a la hora de fabricar dispositivos portátiles interesa que dichos condensadores sean tan pequeños como sea posible.
Sin salir de la electrónica, el tantalio se emplea para fabricar resistencias de alta potencia. Se utiliza también en superaleaciones empleadas en las turbinas de los aviones o los reactores nucleares, así como para recubrir prótesis humanas. Se trata, por todo ello, de un metal imprescindible para la tecnología moderna, aunque hasta el despegue de la ‘electrónica personal’, no se habían necesitado cantidades masivas.
Niobio
Si el tantalio fue bautizado en honor al Tántalo de la mitología griega, su hija Niobe fue la que dio nombre al niobio (símbolo Nb). Esta denominación tiene una razón: el niobio se descubrió precisamente analizando los restos obtenidos de la producción de tantalio. Por lo demás, el niobio es un metal de transición bastante similar al tantalio (se encuentra encima de él en la tabla periódica), aunque más ligero. Sólo una pequeña parte del niobio se usa en electrónica (por tanto, el tantalio es más ‘culpable’ de la moda del coltán). Aun así, sus propiedades lo convierten en un material cotizado.
El niobio se usa en superaleaciones con aplicaciones en la aeronáutica, pero quizá su propiedad más interesante es la superconductividad. Cuando se enfría por debajo de su temperatura crítica (9.2 K, es decir, -264 ºC) su resistencia eléctrica es nula y se puede mantener una corriente eléctrica indefinidamente a través de él. Con esto, se pueden elaborar potentísimos electroimanes, usados por ejemplo en los aparatos de resonancia magnética y en los aceleradores de partículas
TANTALIO
Tantalio - Ta
El tantalio es uno de los compuestos químicos elementales más raros
Propiedades químicas del Tantalio - Efectos del Tantalio sobre la salud - Efectos ambientales del Tantalio
|  |
Tantalio
Elemento
químico cuyo símbolo es Ta, su número atómico es 73 y su peso atómico
180.948. Es un elemento del quinto grupo de la tabla periódica y
pertenece a la serie de los de transición 5d. Se le conocen también estados de oxidación de IV, III y II.
El
metal tantalio se emplea en la fabricación de capacitores para equipo
electrónico, los cuales incluyen radios de banda civil, detectores de
humo, marcapasos cardiacos y automóviles. Se utiliza también en las
superficies para transferencia de calor del equipo de producción en la
industria química, en especial cuando se tienen condiciones
extraordinarias corrosivas. Su inercia química ha hecho que se le hayan
encontrado aplicaciones dentales y quirúrgicas. El tantalio forma
aleaciones con un gran número de metales. Tiene una importancia especial
el ferrotantalio, el cual se agrega a los aceros austeníticos con el
fin de reducir la corrosión intergranular.
El metal es bastante
inerte al ataque con ácidos, excepto al ácido fluorhídrico. Se oxida con
mucha lentitud en soluciones alcalinas. Los halógenos (halogenuros) y
el oxígeno reaccionan con él en caliente, para formar haluros y óxido
correspondientes, con estado de oxidación V. A temperatura elevada
absorbe hidrógeno y se combina con el nitrógeno, el fósforo, el
arsénico, el antimonio, el silicio, el carbono y el boro. El tantalio
forma también compuestos por reacción directa con el azufre, el selenio y
el telurio, a temperaturas elevadas.
Efectos del Tantalio sobre la salud
Puede
ser dañino por inhalación, ingestión o absorción cutánea. Provoca
irritación de los ojos y la piel. El material es irritante de las
membranas mucosas y el tracto respiratorio superior.
No se han
documentado efectos adversos sobre la salud de trabajadores expuestos
industrialmente al tantalio. Dosis masivas de tantalio administradas a
ratas por vía intratraqueal han producido lesiones en el tracto
respiratorio. En contacto con el tejido, el tantalio metálico es inerte.
Efectos ambientales del Tantalio
No
verter el material al medio ambiente sin los adecuados permisos
gubernamentales. Aislar los óxidos de tantalio para prevenir la polución
del medio.
|
Descubierto en 1802 por el químico sueco Anders Gustaf Ekeberg, en un principio se creyó que el tantalio (Ta) y el niobio (Nb)
eran el mismo elemento, lo cual en 1844 fue aclarado por el
químico alemán Heinrich Rose y por último, demostrado científicamente
por el químico suizo Jean Charles Galissard de Marignac en 1866.
Finalmente, el tantalio recibió su nombre del griego Tántalo (Τάνταλος),
nombre de un personaje de la mitología griega, hijo de Zeus, que vivía
en las regiones más oscuras y profundas del inframundo.
Situado en el grupo 5 de los elementos de la tabla periódica, el tantalio es un metal de transición
de características peculiares, de un color gris brillante y metálico
con tintes azulados, dúctil, duro y muy resistente a la corrosión. El
tantalio también posee un alto punto de fusión (es superado únicamente
por dos elementos en este punto) y es un excelente conductor, tanto para
la electricidad como para el calor, siendo prácticamente inmune a los
ataques químicos de temperaturas inferiores a los 150° C.
Es posible encontrar este elemento en la naturaleza, formándose
generalmente en minerales de columbita y tantalita. Australia, Brasil,
Mozambique, Tailandia, Portugal, Nigeria, Zaire y Canadá, Colombia y Venezuela son algunos de
los países en los que más abunda en estado natural; existen dos formas
de aislar el elemento para su producción comercial: mediante
electrólisis, con la reducción de fluorotantalato de potasio con sodio o
haciéndolo reaccionar usando carburo con óxido, en ambos casos,
separándolo así del niobio.
Otros datos
- Número atómico: 73
- Masa atómica: 180,9479 u
- Símbolo atómico: Ta
- Punto de fusión: 3017° C
- Punto de ebullición: 5458° C
¿Para qué se usa el tantalio?

La tantalita es
un mineral para la obtención del tántalo. Suele manifestarse de color
plata grisácea (azul grisáceo), y se convierte en un metal duro y
pesado.
El tantalio o tántalo es un metal de transición que presenta brillo metálico y resiste muy bien la corrosión. Usado para superconductores, aleaciones de aceros especiales, como material ultrarefractario.
Se encuentra en el mineral tantalita, y en menor concentración en la
casiterita de las rocas graníticas. Es inerte al cuerpo, por lo que,
entre sus variadas aplicaciones, se puede emplear para la fabricación de
instrumentos quirúrgicos y en implantes. En ocasiones se le llama
«tántalo», pero el único nombre reconocido por la Real Academia Española
es «tantalio».
El tantalio es un metal denso, pesado, dúctil, maleable, de alto
punto de fusión (3017 °C), y alto punto de ebullición (5458 °C), buen
conductor de la electricidad y del calor y muy duro. Es muy resistente
al ataque por ácidos; se disuelve empleando ácido fluorhídrico o
mediante fusión alcalina. Es muy parecido al niobio y se suele extraer
del mineral tantalita, que en la naturaleza aparece generalmente
formando mezclas isomorfas con la columbita que se conocen con el nombre
de coltán. En la temperatura ambiente se encuentra en el estado sólido. Alcanza el máximo estado de oxidación del grupo, +5.
El metal es bastante inerte al ataque con ácidos, excepto al ácido
fluorhídrico. Se oxida con mucha lentitud en soluciones alcalinas. Los
halógenos (halogenuros) y el oxígeno reaccionan con él en caliente, para
formar haluros y óxido correspondientes, con estado de oxidación V. A
temperatura elevada absorbe hidrógeno y se combina con el nitrógeno, el
fósforo, el arsénico, el antimonio, el silicio, el carbono y el boro. El
tantalio forma también compuestos por reacción directa con el azufre,
el selenio y el telurio, a temperaturas elevadas.
Las Ventajas de los condensadores de tantalio
El tantalio se emplea en los principales circuitos digitales por
su pequeño tamaño, su gran capacitancia (almacenar carga y liberar poco a
poco) y alta frecuencia. Los circuitos digitales generan mucho ruido
eléctrico de alta frecuencia que puede pasar de un circuito a otro a
través de las conexiones de alimentación eléctrica y de señal. Los
condensadores de tantalio son especialmente efectivos en absorber y
atenuar estos picos de ruido antes de que causen problemas.
El uso de tántalo, como polvo de metal, es en la producción de
componentes electrónicos de pequeño tamaño, principalmente en
condensadores de alta potencia y de mucha resistencia como los
condensadores electrolíticos que mejoran cuando tienen una capa
protectora de óxido en la superficie, utilizando polvo de tántalo,
presionado en una forma de pellets, como una “placa” del condensador, el
óxido como dieléctrico , y una solución electrolítica o conductor
sólido como el otro “plato”. Debido a que la capa dieléctrica puede ser
muy delgada (más delgada que la capa similar en, por ejemplo, un
condensador electrolítico de aluminio), una alta conducción se puede
lograr con poco volumen. Debido al tamaño y ventajas de peso, los
condensadores de tantalio son atractivos para la electrónica doméstica,
militar, comercial, e industrial en ordenadores portátiles, de
sobremesa, y electrónica de todo tipo de vehículos y transporte
teledirigido.
Las aplicaciones del tantalio son más conocidas que el nombre del elemento
Se trata de un recurso estratégico, imprescindible en la fabricación
de componentes electrónicos avanzados. El tantalio obtenido a partir
del coltán se usa casi exclusivamente en la fabricación de condensadores electrolíticos de tantalio,
por tanto, un componente esencial de los dispositivos electrónicos muy
compactos: teléfonos móviles, GPS, satélites artificiales, armas
teledirigidas, televisores de LED, videoconsolas o videojuegos, muñecos
habladores, ordenadores portátiles, PDAs, MP3, MP4, drones, equipos
médicos, radios potentes, iluminación LED, recientemente en pantallas flexibles de Oled, vehículos híbridos o cualquier proyecto de alta tecnología que precise una alta resistencia y bajo consumo de energía.
El tantalio es altamente tolerante a los ataques químicos. Esta es la
razón de tántalo es una sustancia valiosa en la fabricación de equipos
de laboratorio. Tantalio también sustituye el metal más precioso, el
platino en muchas reacciones químicas.
Tiene una importancia especial el ferrotantalio, el cual se agrega a
los aceros auténticos con el fin de reducir la corrosión intergranular.
Entre sus compuestos:
El tantalio es altamente resistente a la corrosión debido a una fina
capa o capa de óxido, que se forma en su superficie. El óxido de tántalo
(Ta2O5) tiene un elevado índice de refracción y
se emplea en la fabricación de vidrios especiales para lentes de
cámaras. El índice de refracción negativa ofrece la posibilidad de
superlentes, dispositivo de invisibilidad y otros fenómenos exóticos.
El tantalio es suave cuando es puro y libre de elementos extraños y
puede ser puesto en alambre fino. Alambre fino hecha de tantalio puro se
utiliza como un filamento para la vaporización de metales como el
aluminio.
Se ha obtenido un material composite (híbrido) de grafito y carburo
de tántalo que es uno de los materiales más duros que se conocen y con
un punto de fusión de 3738 ºC. El tántalo de carbono, un tipo de carbeto
muy duro, es usado para producir herramientas de corte, perforación y
máquinas trefiladoras. El 10% del tántalo se emplea en la producción de
TaC (carburo de tántalo) usado para las herramientas de corte.
Tantalio pertenece al grupo de metales refractarios, que se utilizan
ampliamente en la fabricación de superaleaciones. Del mismo modo, que la
mayoría de los otros metales refractarios, las formas duras de tántalo
son carburos y nitruros estables, tales como carburo de tántalo y
nitruro de tántalo.
Tantalio se utiliza en la fabricación de diferentes tipos de
superaleaciones con propiedades que son determinadas, para la alta
tecnología de ultraresistencia, con alto punto de ebullición y alto
punto de fusión.
Propiedad Salazón: Tántalo ha sido sugerido para la tecnología de
armas nucleares por su especial “propiedad salazón.” Aumenta
significativamente la radiactividad de la nube radioactiva de la arma
durante muchos meses.
Ni el tántalo ni sus combinaciones son tóxicos. El tantalio es un
elemento muy biocompatible, sin embargo, debido a sus pobres propiedades
mecánicas y a su alta densidad (16.6 gr/cm3), su utilización está muy
limitada a suturas en cirugía plástica y neurología.
Nuevas aplicaciones del tantalio que reducirán el consumo eléctrico
Pantallas flexibles de tantalio (OLED) son
atractivas para aplicar en grandes pantallas con alto contraste y que
requieran de poco consumo y considerable iluminación, de aquí el
potencial para redefinir muchas soluciones de iluminación de hoy en día.
Esto, en la práctica, va a beneficiar extraordinariamente al mercado de
ordenadores portátiles y pequeños terminales, en el que uno de los
grandes consumidores de energía es precisamente la pantalla.
Sin salir de la electrónica, el tantalio también se emplea
para fabricar resistencias de alta potencia (las resistencias son otro
componente básico de los circuitos electrónicos).
Nuevas memorias de tantalio para almacenamiento más denso y con menor
consumo energético, esta nueva tecnología de memoria, sobre todo, será
aplicada para almacenar vídeo de alta resolución o para guardar el
enorme volumen de datos que los servidores de internet
necesitan almacenar.
Se utiliza también en superaleaciones empleadas en las turbinas de los aviones o para la salazón en los reactores nucleares, revestimiento de utensilios o equipo químico, aviones, cohetes, y prótesis humanas.
En equipamientos para procesos químicos, piezas de cohetes, misiles,
elementos de transmisión de alta tecnología como satélites y todo tipo
de artefactos o transportes teledirigidos o de geolocalización.
.El tantalio es un metal raro de gran densidad y ciertas propiedades resistentes que lo hacen un material de construcción muy buscado. Puedes hallarlo en casi cualquier pieza de electrónico de uso diario, desde hasta , e incluso en finos. Es muy versátil y también se presta a usos militares, como armaduras de vehículos, explosivos y construcción de misiles.
El
tantalio a menudo se muele hasta formar un polvo que se usa en la
producción de partes eléctricas. El tantalio forma una capa oxidada
alrededor de capacitores y resistencias de alta potencia, aislándolas
del daño debido a las altas temperaturas de operación. Estos capacitores
a menudo se encuentran en teléfonos móviles, sistemas de tableros
eléctricos de automóviles y computadoras personales.
Aleaciones metálicas
El
tantalio tiene una buena conductividad eléctrica y un alto punto de
fusión. Se usa para producir aleaciones metálicas que aprovechan estas
propiedades y están integradas a estructuras mayores, como en reactores
nucleares, partes de aeronaves y equipos para procesar químicos. El
tantalio también resiste la mayoría de los ácidos y todos los fluidos
corporales, haciéndolo ideal para transmisores de radio y equipamiento
quirúrgico.
Tanques y explosivos
Debido
a su alto punto de fusión y su densidad, el tantalio se usa en cargas y
dispositivos explosivos penetrantes para penetrar en la armadura de
vehículos. De forma inversa, la misma densidad y alto punto de fusión lo
hacen perfecto para la armadura de los tanques.
Niobio - Nb
Propiedades químicas del Niobio - Efectos del Niobio sobre la salud - Efectos ambientales del Niobio
|  |
Niobio
Símbolo
Nb, número atómico 41 y peso atómico 92.906. En Estados Unidos este
elemento se llamó originalmente columbio. La industria metalúrgica y los
metalurgistas aún utilizan este nombre antiguo.
La mayor parte
del niobio se usa en aceros inoxidables especiales, en aleaciones de
alta temperatura y en aleaciones superconductoras como Nb3Sn. El niobio también se utiliza en pilas nucleares.
Es
muy inerte a todos los ácidos, menos el fluorhídrico, supuestamente por
tener una película de óxido sobre la superficie. El niobio metálico se
oxida lentamente en solución alcalina. Reacciona con el oxígeno y los
halógenos en caliente para formar los halogenuros y el óxido en estado
de oxidación V, con nitrógeno para formar NbN y con carbono para formar
NbC, así como con otros elementos como arsénico, antimonio, teluro y
selenio.
El óxido Nb2O5, que se funde a 1520º (2768ºF), se disuelve en álcali fundido para formar un niobato complejo soluble, Nb6O198-. Los niobatos normales, entre ellos el NbO43-, son insolubles. El óxido se disuelve en ácido fluorhídrico para producir especies iónicas como NbOF52- y NbOF63-, según la concentración de los iones fluoruro e hidrógeno. El complejo fluorado mayor que puede existir en solución es NbF6-.
Efectos del Niobio sobre la salud
El
niobio, cuando es inhalado, es retenido principalmente en los pulmones,
y secundariamente en los huesos. Interfiere con el calcio como
activador del sistema enzimático. En los animales de laboratorio, la
inhalación de nitruro o pentóxido de niobio resulta en cicatrizaciones
de los pulmones a niveles de exposición superiores a los 40 mg/m3.
ambién llamado columbio, el niobio es el elemento número 41 de la tabla periódica. Es un metal muy peculiar y poco abundante. Bien acostumbrado ya estarás a esta clásica sección de química, así que sin mucho que explicarte, hoy te propongo conocer todas las propiedades, los usos y las características del niobio.
Características generales y propiedades del niobio
iStockphoto/Thinkstock
En el año 1734, John Winthrop encontró un extraño mineral en Massachusetts, EE.UU., y lo envió a Inglaterra. Una vez allí, el mineral se expuso en el Museo Británico durante muchos años hasta que en 1801, fue analizado por el químico inglés Charles Hatchett. Tras analizar el mineral, Hatchett encontró en él un nuevo elemento y lo llamó columbio en honor a Columbia, la personificación poética femenina que designa a Estados Unidos en poesía. En el año 1809, el físico químico inglés William Hyde Wollaston lo comparó con varios otros elementos y declaró que en realidad se trataba del tantalio. En 1844, el minerólogo y químico alemán Heinrich Rose, trabajando con muestras de ambos minerales (columbita y tantalita), logró separar estos elementos en formas ácidas, a las cuales llamó ácido nióbico y ácido pelópico, cambiando el nombre del elemento a niobio. Pero la historia no termina allí, sino cuando veinte años más tarde, el químico suizo Jean Charles de Marignac Galissard logró aislar niobio metálico calentando cloruro en una atmósfera de hidrógeno. 
El elemento terminó conociéndose como columbio durante más de 100
años en Estados Unidos y niobio en Europa. En 1949, el elemento fue
oficialmente llamado niobio
por dictamen de la Unión Internacional de Química Pura y Aplicada. No
obstante, en el sector metalúrgico y las sociedades del metal, muchas
personas siguen refiriéndose a este elemento como columbio.
El niobio es un metal brillante y grisáceo, dúctil,
blando y escaso. Toma un color azulado cuando se lo expone al aire o a
temperatura ambiente durante un determinado período de tiempo. Es un
metal de transición y se sitúa en el grupo 5 de los elementos de la tabla periódica.
Se conocen 18 isótopos de este extraño metal y en las actividades
humanas, es empleado en aleaciones que le dan resistencia, especialmente
con el acero.
Si bien encontrar este elemento es un tanto dificultoso, se lo puede
hallar en minerales, aislar del tantalio y también producir de forma
artificial. En la naturaleza, el niobio se encuentra en minerales de
columbita, sobre todo en regiones de países como Brasil, Canadá, Nigeria
y Rusia.
Otros datos:
¿Para qué se usa el niobio?
El niobio se usa especialmente en el sector de la construcción y la
industria metalúrgica, especialmente en varillas de soldadura por arco y
para estabilizar acero inoxidable. También es ampliamente aplicado en
la construcción de estructuras aéreas avanzadas. Por sus propiedades
superconductoras se lo ha empleado con funciones magnéticas y su uso más popular refiere a la joyería.
|
El tantalio y el niobio son metales que,
gracias a sus excepcionales propiedades, resisten altas temperaturas y
ataques de la corrosión. Actualmente, son empleados en la fabricación de
componentes electrónicos, aleaciones superresistentes. Por su
ductilidad permiten ser alambre, láminas tubos.
Las mineralizaciones del Ta y Nb,
económicamente, más valiosas e importantes son la Tantalita –compuesto
de óxido de tantalio, hierro y manganeso – y la Columbita –compuesto de
óxido de niobio, hierro y manganeso –. El niobio, también conocido como columbio, tiene otra mineralización muy importante: el pirocloro, el cual se forma principalmente en rocas carbonatitas.
El niobio
(o columbio) es un elemento químico de número atómico 41 situado en el
grupo 5 de la tabla periódica de los elementos. Se simboliza como Nb. Es
un metal de transición dúctil, gris, blando y poco abundante. Se
encuentra en el mineral niobita, también llamado columbita, y se utiliza
en aleaciones. Se emplea principalmente aleado en aceros,
confiriéndoles una alta resistencia. Se descubrió en el mineral niobita.
El niobio tiene propiedades físicas y químicas similares a las del elemento tantalio
, y los dos son, por lo tanto difíciles de distinguir. En 1864 y 1865,
una serie de descubrimientos científicos clarificó que niobio y
columbio eran el mismo elemento (a diferencia de tantalio ), y desde
hace un siglo se utilizaron ambos nombres indistintamente. El niobio fue
adoptado oficialmente como el nombre del elemento en 1949 , pero el
nombre de columbio sigue siendo de uso corriente en la metalurgia en los
Estados Unidos. No fue hasta el siglo 20 que el niobio fue utilizado
por primera vez en el mercado.
Aplicaciones del Niobio
El niobio se utiliza sobre todo en
aleaciones, la mayor parte en acero especial igual que el utilizado en
tuberías de gas. Aunque las aleaciones contienen sólo un máximo de 0,1
%, este pequeño porcentaje de niobio mejora la resistencia del acero. El
niobio se utiliza en diversos materiales superconductores. Estas
aleaciones superconductoras, también contienen titanio y estaño, que son
ampliamente utilizados en los imanes superconductores de escáneres de
resonancia magnética. Otras aplicaciones de niobio incluyen su uso en
soldadura, industrias nucleares, electrónica, óptica, numismática y
joyería. En las dos últimas aplicaciones, bajo nivel de toxicidad de
niobio y capacidad de ser coloreado por anodización son ventajas
particulares .
¿Por qué es un Material Estratégico?
La importancia estratégica del Ta y el
Nb radica en que, gracias a sus extraordinarias propiedades, desde
hace un poco más de medio siglo se han convertido en esenciales e
imprescindibles para la tecnología moderna.
Tanto el Tantalio como el Niobio son empleados para fabricar
componentes de nuevas tecnologías: procesadores y condensadores
electrónicos, intercambiadores de calor y aleaciones superresistentes a
la abrasión, corrosión y temperatura.
El niobio tiene menos aplicaciones electrónicas que el Ta y su mayor
uso es en forma de Ferro-Niobio como aleante para aceros, y como carburo
de niobio en aceros para herramientas de mecanizado de alta velocidad
(MAV).
El crecimiento en el consumo de este
material, en los últimos 30 años, es consecuencia de la alta demanda de
aleaciones de acero de alta resistencia mecánica, aceros de baja
aleación y aceros inoxidables en los que el Nb es utilizado para el
control del tamaño del grano, pues mejora las propiedades mecánicas y la
relación resistencia-peso del acero. Tales aceros son utilizados para
aumentar la durabilidad de puentes, torres, columnas, estructuras
elevadas y tuberías de hidrocarburos.
El Nb se emplea también, aleado con
tungsteno, titanio y molibdeno para resistir elevadas temperaturas en
reactores nucleares y válvulas electrónicas.
En los aceros para construcción semicalmados, bajos en carbono, el Nb sirve para elevar el límite elástico y la resistencia a la tracción; por ello, su empleo se extiende cada día más como reemplazo de aceros de baja aleación.
El niobio disminuye la templabilidad, por lo que se añade a aceros previamente templados para evitar grietas en procesos como soldadura. En aceros al carbono incrementa la dureza y la fuerza coersiva, por ello se utiliza en las aleaciones para imanes permanentes. El vanadio, manganeso y molibdeno pueden sustituir al Nb como agente aleante en aceros de alta resistencia. Igualmente, el tantalio puede reemplazarlo en aceros inoxidables y de alta resistencia mecánica, pero se requieren dos veces más de Ta para obtener el mismo efecto, por esta razón la industria del acero prefiere el Nb, más económico obtenido a partir del mineral pirocloro.
Dado lo anterior, por su aplicación y servicio final, la industria de la construcción constituye el mayor consumidor de Ferro-Niobio mundialmente; incluso, por años, ha sido usado para aumentar la resistencia mecánica de las barras para hormigón.
La industria siderúrgica proyecta que el consumo de Nb tendrá un continúo crecimiento en el siguiente lustro en las industrias del petróleo, gas y transporte. También se espera un fuerte incremento en la demanda de óxido de Nb y Ferro-Niobio, para aplicaciones nucleares y aeroespaciales.
En los aceros para construcción semicalmados, bajos en carbono, el Nb sirve para elevar el límite elástico y la resistencia a la tracción; por ello, su empleo se extiende cada día más como reemplazo de aceros de baja aleación.
El niobio disminuye la templabilidad, por lo que se añade a aceros previamente templados para evitar grietas en procesos como soldadura. En aceros al carbono incrementa la dureza y la fuerza coersiva, por ello se utiliza en las aleaciones para imanes permanentes. El vanadio, manganeso y molibdeno pueden sustituir al Nb como agente aleante en aceros de alta resistencia. Igualmente, el tantalio puede reemplazarlo en aceros inoxidables y de alta resistencia mecánica, pero se requieren dos veces más de Ta para obtener el mismo efecto, por esta razón la industria del acero prefiere el Nb, más económico obtenido a partir del mineral pirocloro.
Dado lo anterior, por su aplicación y servicio final, la industria de la construcción constituye el mayor consumidor de Ferro-Niobio mundialmente; incluso, por años, ha sido usado para aumentar la resistencia mecánica de las barras para hormigón.
La industria siderúrgica proyecta que el consumo de Nb tendrá un continúo crecimiento en el siguiente lustro en las industrias del petróleo, gas y transporte. También se espera un fuerte incremento en la demanda de óxido de Nb y Ferro-Niobio, para aplicaciones nucleares y aeroespaciales.
¿Cómo se Extraen y Procesan?
Ocasionalmente, se encuentran grandes cantidades de elementos y compuestos metálicos concentrados por procesos geológicos en un área pequeña; si después de identificado el sitio, y cuantificado el material, se concluye que la extracción es económicamente rentable, entonces, a estos depósitos de minerales, de interés económico, se les llama ‘mena’ y el lugar donde se encuentran acumulados es denominado un yacimiento.


