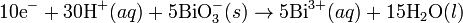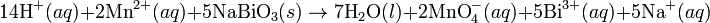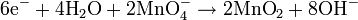Joseph Louis Proust
LEY DE LAS PROPORCIONES DEFINIDAS O COMPOSICIÒN CONSTANTE
Esta ley fue enunciada en 1799 por
Joseph Louis Proust
(Angers, 1754- id., 1826) Químico francés. Emigrado a España, fue profesor en Segovia y en Salamanca y dirigió en Madrid un laboratorio que le hizo construir Carlos IV. Miembro de la Academia de Ciencias francesa, llevó a cabo numerosos trabajos de análisis de cuerpos compuestos y estableció la ley de las proporciones definidas.
Joseph Louis Proust comenzó a estudiar en el laboratorio de su padre, a la sazón farmacéutico, y al mismo tiempo en el colegio de los oratorianos de su ciudad natal. Continuó sus estudios en París, donde trabó amistad con Lavoisier y ganó en 1776, tras un brillante concurso, el puesto de farmacéutico jefe en el hospital de la Salpêtrière. Por aquella época publicó sus primeros trabajos e inició su labor docente en el museo de su amigo Pilâire de Rozier, en cuyas experiencias aerostáticas participó. Esta vocación por la enseñanza le haría abandonar París a fines de 1778 y establecerse en Vergara (Guipúzcoa) para desempeñar la cátedra de química en el Real Seminario Patriótico, fundado poco antes por la Real Sociedad Económica Vascongada de Amigos del País.
Regresó a su patria en 1780, hasta que años más tarde fue llamado por Carlos IV y designado, en 1785, profesor de química del Real Colegio o Academia Militar para Oficiales y Caballeros Cadetes de Artillería, instalada en el alcázar de Segovia desde 1763. Desde 1799 hasta 1806 dirigió el laboratorio que el rey le hizo construir en Madrid. Éste era el resultado de la fusión de sendos laboratorios dependientes de los ministerios de Estado y de Hacienda, dirigidos hasta entonces, respectivamente, por Pedro Gutiérrez Bueno y Francisco Chavaneau. En 1798 había contraído matrimonio con una compatriota, la aristócrata Ana Rosa de Chatelain D’Aubigne, refugiada en España a raíz de la persecución de la aristocracia que instauró la Convención (1792-1795), y con ella regresó a Francia a fines de 1806, cansado y posiblemente enfermo. Allí se enteró, en 1808, del saqueo de su laboratorio durante el levantamiento popular producido en Madrid contra el invasor francés, así como de la pérdida de su empleo.
Tras una breve estancia en París fijó su residencia en su región natal, concretamente en el pueblo de Craon. Fueron años de penuria económica y, al mismo tiempo, de importantes logros científicos: en 1808 descubrió el azúcar de uva o glucosa, después de que Napoleón I invitara a todos los químicos franceses a buscar una nueva sustancia que remediara la escasez de edulcorantes causada por la guerra. Sin embargo, ya en España Proust había anticipado este descubrimiento (1799), e incluso había publicado en Madrid su obra Ensayo sobre el azúcar de uva (1806). Para la investigación y producción de dicha sustancia recibió, en 1810, una subvención que no terminó de remediar su maltrecha situación económica.
Las reiteradas negativas del gobierno español de Fernando VII ante la petición por parte de Proust de una pensión o al menos de algunas compensaciones, así como algunos problemas familiares, aumentaron aún más la natural introversión del sabio francés, que vivió aislado en su casa de Craon hasta finales de 1817. Poco antes, en 1816, había tenido lugar el primer reconocimiento oficial de sus méritos científicos al ser nombrado académico de número de la Academia de Ciencias de París. Sin embargo, la muerte de su esposa, ocurrida al año siguiente, hizo que Proust se retirara de forma definitiva a su ciudad natal y viviera el resto de sus días en total aislamiento, ni siquiera perturbado por sus nombramientos como caballero de la Legión de Honor (1819), miembro de la Real Academia de Ciencias de Nápoles (1819) y miembro asociado no residente de la Real Academia de Medicina de París (1820).
Joseph Louis Proust fue uno de los más relevantes químicos de su época. Entre sus aportaciones a la química sobresale, además del descubrimiento de la glucosa, el establecimiento la ley de las proporciones definidas que lleva su nombre y que le supuso una famosa y larga controversia (1801-1807) con su compatriota Claude Berthollet. La ley de las proporciones definidas establece que, cuando varios elementos se combinan para formar un determinado compuesto, lo hacen en una relación de pesos fija. Así, por ejemplo, 1,11 gramos de hidrógeno siempre se combinan con 8,89 gramos de oxígeno para formar 10 gramos de agua. Si aumentamos la cantidad de oxígeno y no la de hidrógeno, se obtiene la misma cantidad de agua: el exceso de oxígeno queda sin reaccionar.
En la reacción descrita, al hidrógeno se le llama reactivo limitante de la reacción porque ésta deja de producirse cuando se agota esa sustancia. Con la ley de las proporciones definidas, Proust demostró que cada compuesto contiene sus elementos en unas proporciones fijas, independientemente del modo en que se prepare. Por ejemplo, el cloruro de sodio (NaCl) se puede obtener haciendo reaccionar hidróxido de sodio con ácido clorhídrico (NaOH + HCI) o, por el contrario, tratando carbonato de sodio con ácido clorhídrico (NaCO3 + HCI). Comprobamos que en ambos casos llegamos a un compuesto que contiene un 39,33 % de sodio y un 60,66 % de cloro