LA MATERIA Y SUS PROPIEDADES
PROPIEDADES CARACTERÍSTICAS DE LA MATERIA
A simple vista podemos distinguir entre muchos tipos de sustancias: la madera, el plástico, el oro, la plata y muchas más. Hay características que permiten diferenciar los distintos tipos de materia; reciben el nombre de propiedades características, y permiten identificar las sustancias.
A Estas propiedades se les llaman a menudo constantes físicas, siendo su utilidad en el trabajo del químico notable, ya que sus valores son altamente confiables no solo para identificar una sustancia sino también para determinar su grado de pureza.
Para identificar una sustancia no basta con conocer una de sus propiedades características, sino varias de ellas, las más importantes son: la densidad, el punto de fusión y ebullición, asociados con la temperatura, y la solubilidad, que también tiene que ver, de otra forma, con la temperatura.
Las propiedades características se determinan a través del análisis, cualitativo y del cuantitativo.
En los análisis cuantitativos se encuentran las propiedades características medibles; y en el análisis cualitativo, las propiedades características no medibles.
Las propiedades características medibles son:
- Densidad: masa de un cuerpo por unidad de volumen
- Punto de fusión: temperatura a la que el estado sólido y el estado líquido de una sustancia se encuentran en equilibrio.
- Punto de ebullición: temperatura a la que la presión de vapor de un líquido se iguala a la presión atmosférica existente sobre dicho líquido.
- Solubilidad: La solubilidad es una medida de la capacidad de una determinada sustancia para disolverse en otra. Puede expresarse en moles por litro, en gramos por litro, o en porcentaje de soluto; en algunas condiciones se puede sobrepasarla, denominándose a estas soluciones sobresaturadas. El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra. La sustancia que se disuelve se denomina soluto y la sustancia donde se disuelve el soluto se llama disolvente.
Las propiedades características no medibles son:
- Olor: es una propiedad intrínseca de la materia y se define como la sensación resultante de la recepción de un estímulo por el Sistema Sensorial Olfativo.
- Sabor: es la impresión que nos causa un alimento u otra sustancia, y ésta determina principalmente por sensaciones alucinógenas combinadas, detectada por el gusto.
- Textura: es la propiedad que tienen las superficies externas de los objetos, así como las sensaciones que causan, que son captadas por el sentido del tacto.
- Brillo: es el resultante de la reflexión y la refracción de la luz en la superficie de un mineral.
DENSIDAD
El concepto de densidad es de mucha importancia en los campos de Química y Física. La densidad es la relación que existe entre la masa y el volumen de una sustancia.
ρ = masa / volumen
ρ (rho) = densidad
Es una propiedad intensiva porque no varía con la cantidad de sustancia. Por ejemplo la densidad del agua es de 1 g/cm3. (un gramo sobre centímetro cúbico). Si tenemos 10 gramos o 200 gramos de agua el valor de la densidad sera el mismo ya que al aumentar la masa también aumentara el volumen y al hacer la división entre masa y volumen obtendremos el mismo valor de densidad.
La densidad también es un nexo muy importante para transformar masa a volumen o viceversa, es decir calcular bien el equivalente de una a la otra. Por ejemplo en el caso de los líquidos a veces nos preguntan que saquemos cierta masa del mismo como si necesitamos 30 gramos de ácido sulfúrico. La densidad es de 1,84 g/cm3. Con la masa y la densidad calculamos facilmente el equivalente de su volumen. Despejamos el volumen de la formula antes indicada nos queda:
Volumen = masa / ρ
V = 30 g / 1.84 g/cm3 = 16,3 cm3
De esta manera medimos este volumen con una pipeta adecuada y tendremos en este volumen la masa que nos habían pedido al inicio. De la misma manera si nos pedirian un cierto volumen de un solido lo podríamos calcular con la densidad. La masa sería igual al producto de la densidad y el volumen de dato y asi pesamos al solido, ya que es mas fácil en los solidos medirlos por pesada y a los líquidos medirlos en volumen como en el ejemplo anterior.
Ejercicios:
Como se observa la fórmula es sencilla ya que solo tiene tres componentes, densidad, masa y volumen. Con dos datos podremos calcular la incognita faltante.
1) ¿Qué volumen ocupara una masa de 608 grs de aluminio?
ρ = 2,7 g/cm3
V = masa / ρ
V = 608 g / 2,7 g/cm3
V = 225 cm3
2) ¿Qué masa tendra un cubo de 10 cm de lado hecho de corcho?
ρ = 0,14 g/cm3.
Antes que todo, necesitamos saber el volumen del cuerpo para calcular la masa.
El volumen de un cuerpo lo calculamos con la formula del volumen de un cubo. V = lado x lado x lado. V = 10 x 10 x 10 = 1000 cm3.
masa = ρ x V
masa = 0,14 g/cm3 x 1000 cm3
masa = 140 g
Todos los cálculos, en lo posible, han de hacerse mediante el método de los factores de conversión. Analice los ejemplos siguientes de aplicación de este método.
Factor de conversión
El factor de conversión o de unidad es una fracción en la que el numerador y el denominador son cantidades iguales expresadas en unidades de medida distintas, de tal manera, que esta fracción equivale a la unidad.
Cada factor de conversión se construye con una equivalencia (igualdad entre dos cantidades).
Cada factor de conversión se construye con una equivalencia (igualdad entre dos cantidades).
- Ejemplo 1: pasar 15 pulgadas a centímetros (equivalencia: 1 pulgada = 2,54 cm )

- el factor unitario :
 se construye a partir de la equivalencia dada.
se construye a partir de la equivalencia dada.
- Ejemplo 2: pasar 25 metros por segundo a kilómetros por hora(equivalencias: 1 kilómetro = 1000 metros, 1 hora = 3600 segundos)
Ejemplo 3: obtener la masa de 10 litros de mercurio (densidad del mercurio: 13,6 kilogramos por decímetro cúbico)
- Nótese que un litro es lo mismo que un decímetro cúbico.

- En cada una de las fracciones entre paréntesis se ha empleado la misma medida en unidades distintas de forma que al final sólo quedaba la unidad que se pedía
- Usando este método, efectúe los siguientes ejercicios:
SOLUBILIDAD
- La solubilidad es capacidad que posee una sustancia para poder disolverse en otra. Dicha capacidad puede ser expresada en moles por litro, gramos por litro o también en porcentaje del soluto.
- Generalmente, para hacer que el soluto se disuelva se suele calentar la muestra, de este modo, la sustancia disuelta se conoce como soluto y la sustancia donde se disuelve el soluto se conoce como disolvente.Las sustancias no se disuelven en los mismos disolventes; el
agua, por ejemplo, disuelve fácilmente el alcohol o la sal, pero en cambio, no se disuelven en ella el aceite o la gasolina. La solubilidad de una sustancia es dependiente de la naturaleza, tanto del soluto como del disolvente, así como también de la temperatura y presión a la que esté sometido el sistema. La interacción de las moléculas del disolvente con las del soluto, para conseguir formar agregados se conocen como solvatación, pero si el disolvente es agua, a este proceso se conocerá como hidratación. - Miscibilidad es un término usado en química que se refiere a la propiedad de algunos líquidos para mezclarse en cualquier proporción, formando una disolución. En principio, el término es también aplicado a otras fases (sólidos, gases), pero se emplea más a menudo para referirse a la solubilidad de un líquido en otro. El agua y el etanol (alcohol etílico), por ejemplo, son miscibles en cualquier proporción.Por el contrario, se dice que las sustancias son inmiscibles si en alguna proporción no son capaces de formar una fase homogénea. Por ejemplo, el éter etílico es en cierta medida soluble en agua, pero a estos dos solventes no se les considera miscibles dado que no son solubles en todas las proporciones.
- Cada sustancia tiene una solubilidad para un solvente determinado. La solubilidad es la cantidad máxima de soluto que puede mantenerse disuelto en una solución, y depende de condiciones como la temperatura, presión, y otras sustancias disueltas o en suspensión. Cuando se alcanza la máxima cantidad de soluto en una solución se dice que la solución está saturada, y ya no se admitirá más soluto disuelto en ella. Si agregamos un poco de sal común a un vaso de agua, por ejemplo, y la agitamos con una cucharita, la sal se disolverá. Si continuamos agregando sal, habrá cada vez más concentración de está hasta que el agua ya no pueda disolver más sal por mucho que la agitemos. Entonces, la disolución estará saturada, y la sal que le agreguemos, en vez de disolverse se precipitará al fondo del vaso. Si calentamos el agua, está podrá disolver más sal (aumentará la solubilidad de la sal en el agua), y si la enfriamos, el agua tendrá menos capacidad para retener disuelta la sal, y el exceso se precipitará.
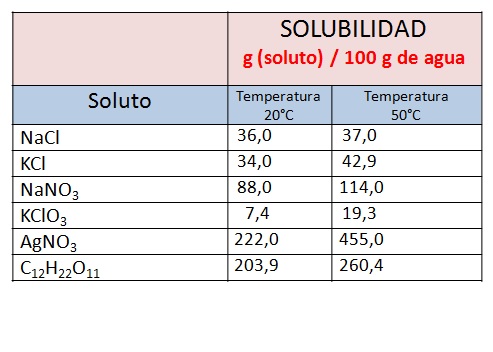
- TABLA DE SOLUBILIDAD
A continuación se muestra una tabla con los límites de solubilidad de algunas sustancias en agua a dos temperaturas distintas. Observe que la cantidad de soluto que podemos disolver es mayor cuando la temperatura del solvente es mayor.
EJERCICIOS
- Una solución se prepara agregando 23,5 g de nitrato de sodio (NaNO3) a 20 mL de agua a 50°C. ¿La solución será saturada, insaturada o sobresaturada? (Nota: utilice el dato de la tabla anterior).
- La solubilidad del MnSO4 en agua a 20°C es de 7 mg por cada mililitro de agua. Un litro de esta solución contienen 1,22 moles de MnSO4 en agua a 20°C, ¿la solución será saturada, sobresaturada o insaturada?
- Una solución se prepara agregando 2,5 g de KCl a 10 g de agua, ¿la solución preparada será saturada, no saturada o sobre saturada a 20°C? (Nota: utilice el dato de la tabla anterior).
- Resuelva, además, los ejercicios sobre solubilidad que se publican en el vínculo siguiente http://solanolgonzalov.blogspot.com/2015/11/solubilidad.html?m=1







No hay comentarios.:
Publicar un comentario
Nota: sólo los miembros de este blog pueden publicar comentarios.