TEORÍA DEL ENLACE DE VALENCIA
La teoría propone que un enlace covalente resulta cuando dos átomos se aproximan el uno al otro lo bastante cerca de tal manera que un orbital de valencia ocupando por un electrón en un átomo solapa con el orbital de valencia también ocupado por u electrón. Los electrones ahora apareados en el orbital solapado son atraídos hacia el núcleo de ambos átomos y así enlaza los dos átomos juntos.El enlace se forma por superposición o solapamiento de orbitales atómicos de los átomos enlazados y apareamiento de espines de electrones situados en orbitales atómicos con un solo eelectrón.
La superposición de orbitales atómicos de los átomos enlazados genera una alta densidad de carga negativa en la región internuclear que determina una disminución de la energía potencial del sistema, suficiente para estabilizar la unión entre los átomos. Cuanto mayor sea la extensión del solapamiento, mayor será el descenso de la energía potencial y más fuerte el enlace.
Conforme con la teoría, cada orbital atómico semiocupado significa una posibilidad de formar un enlace covalente.
Las ideas clave de la teoría enlace son las siguientes:
.- Los enlaces covalentes están formados por el solapamiento de orbitales atómicos, cada uno de los cuales contienen un electrón con opuesta orientación del espín electrónico.
.- Cada uno de los átomos enlazados mantiene sus propios orbitales atómicos, pero el par de electrones en los orbitales enlazados es compartido por ambos átomos.
.- Cuanto mayor sea la cantidad de solapamiento, más fuerte es el enlace. Esto conduce a carácter direccional de este cunado orbitales diferentes al s están involucrados.
Por ejemplo en la molécula de  el enlace
el enlace  resulta del solapamiento de dos orbitales s ocupados con un único electrón.
resulta del solapamiento de dos orbitales s ocupados con un único electrón.
 el enlace
el enlace  resulta del solapamiento de dos orbitales s ocupados con un único electrón.
resulta del solapamiento de dos orbitales s ocupados con un único electrón.
Los orbitales atómicos que más corriente participan en los enlaces son los s y los p. el solapamiento puede ser:
A.- Frontal, cuando la región de solapamiento es atravesada por el segmento internuclear, que se da en uniones s-s, s-p y en algunos casos p-p, y recibe el nombre de enlace sigma (σ).
B.- Lateral, cuando la región de solapamiento queda fuera del segmento internuclear, que se da en la mayor parte de las unioes p-p y se denomina enlace pi (π).
En general, los enlace sigma son como el esqueleto de las moléculas, su sostén estructural, mientras que los enlaces pi son más reactivos y más susceptibles a perturbaciones electomagnéticas exteriores.
La valencia y la esteroquímica del carbono parace contradecir la teoría de valencia. El carbono tiene en su configuración electrónica fundamental ![[He] 2s^2 2p_x^1 2p_y^1 [He] 2s^2 2p_x^1 2p_y^1](http://www.wikillerato.org/images/math/math-61adb0414d00c394f7baf55d0318a268.png) . Según esta configuración el carbono tiene cuatro electrones de valencia, dos de los cuales están apareados en el orbital 2s y otros dos ocupan de manera desapareada dos orbitales 2p semiocupados, por lo que el carbono debería ser divalente. Pero por ejemplo en una molécula como el metano
. Según esta configuración el carbono tiene cuatro electrones de valencia, dos de los cuales están apareados en el orbital 2s y otros dos ocupan de manera desapareada dos orbitales 2p semiocupados, por lo que el carbono debería ser divalente. Pero por ejemplo en una molécula como el metano  , el carbono muestra la típica tetravalencia de este elemento. Pero como el carbono puede formar cuatro enlaces si dos electrones de valencia están ya apareados y solo dos electrones no apareados están disponibles para compartir?.
, el carbono muestra la típica tetravalencia de este elemento. Pero como el carbono puede formar cuatro enlaces si dos electrones de valencia están ya apareados y solo dos electrones no apareados están disponibles para compartir?.
![[He] 2s^2 2p_x^1 2p_y^1 [He] 2s^2 2p_x^1 2p_y^1](http://www.wikillerato.org/images/math/math-61adb0414d00c394f7baf55d0318a268.png) . Según esta configuración el carbono tiene cuatro electrones de valencia, dos de los cuales están apareados en el orbital 2s y otros dos ocupan de manera desapareada dos orbitales 2p semiocupados, por lo que el carbono debería ser divalente. Pero por ejemplo en una molécula como el metano
. Según esta configuración el carbono tiene cuatro electrones de valencia, dos de los cuales están apareados en el orbital 2s y otros dos ocupan de manera desapareada dos orbitales 2p semiocupados, por lo que el carbono debería ser divalente. Pero por ejemplo en una molécula como el metano  , el carbono muestra la típica tetravalencia de este elemento. Pero como el carbono puede formar cuatro enlaces si dos electrones de valencia están ya apareados y solo dos electrones no apareados están disponibles para compartir?.
, el carbono muestra la típica tetravalencia de este elemento. Pero como el carbono puede formar cuatro enlaces si dos electrones de valencia están ya apareados y solo dos electrones no apareados están disponibles para compartir?.
La respuesta es que un electrón debe ser promovido desde el nivel más bajo de energía del orbital 2s al orbital vacante 2p de mayor energía dando una configuración de estado excitada![[He] 2s^1 2p_x^1 2 p_y^1 2p_z^1 [He] 2s^1 2p_x^1 2 p_y^1 2p_z^1](http://www.wikillerato.org/images/math/math-a830b95a06283c6dc9610fab903d7770.png) con cuatro electrones desaparerados. Este fenómeno de promoción electrónica (excitación) por el que un electrón del subnivel s pasa al subnivel p para semiocupar un orbital, con lo que resultan cuatro espines sin aparear que explicarían las cuatro valencias del carbono.
con cuatro electrones desaparerados. Este fenómeno de promoción electrónica (excitación) por el que un electrón del subnivel s pasa al subnivel p para semiocupar un orbital, con lo que resultan cuatro espines sin aparear que explicarían las cuatro valencias del carbono.
![[He] 2s^1 2p_x^1 2 p_y^1 2p_z^1 [He] 2s^1 2p_x^1 2 p_y^1 2p_z^1](http://www.wikillerato.org/images/math/math-a830b95a06283c6dc9610fab903d7770.png) con cuatro electrones desaparerados. Este fenómeno de promoción electrónica (excitación) por el que un electrón del subnivel s pasa al subnivel p para semiocupar un orbital, con lo que resultan cuatro espines sin aparear que explicarían las cuatro valencias del carbono.
con cuatro electrones desaparerados. Este fenómeno de promoción electrónica (excitación) por el que un electrón del subnivel s pasa al subnivel p para semiocupar un orbital, con lo que resultan cuatro espines sin aparear que explicarían las cuatro valencias del carbono.
No obstante una segunda dificultad importante surge del hecho de que la molécula de metano es tetraédrica, según revelan los datos experimentales, lo que es incompatible con la geometría de los orbitales implicados en el enlace; en el estado excitado el carbono utiliza un orbital s de simetría esférica y tres de simetría p cilíndrica alrededor de los tres ejes x, y, y z ¿como podrían formarse cuatro enlaces equivalente? Además si los orbitales 2p en el carbono están en ángulos de 90º entre ellos, y si el orbital 2s no tiene direccionalidad, como el carbono forma enlaces con ángulos de 109.5 º dirigidos hacia las esquinas de un tetraedro regular?
Las respuestas a estas cuestiones fueron proporcionadas por el químico Linus C. Pauling en 1931 al introducir la idea de los orbitales híbridos. Pauling mostró que la función de onda mecanico cuántica para los orbitales s y p derivadas de la ecuación de onda de Schrödinger puede ser matemáticamente combinada para formar un nuevo conjunto de funciones de onda equivalentes llamadas orbitales atómicos híbridos. Cuando un orbital s se combina con tres orbitales p, como ocurre en un átomo de carbono en estado excitado, cuatro orbitales híbrido llamados  resultan (el superíndice 3 en el nombre
resultan (el superíndice 3 en el nombre  indica la cantidad de orbitales atómicos p combinados para construir los orbitales híbridos, y no la cantidad de electrones que ocupan cada orbital.
indica la cantidad de orbitales atómicos p combinados para construir los orbitales híbridos, y no la cantidad de electrones que ocupan cada orbital.
 resultan (el superíndice 3 en el nombre
resultan (el superíndice 3 en el nombre  indica la cantidad de orbitales atómicos p combinados para construir los orbitales híbridos, y no la cantidad de electrones que ocupan cada orbital.
indica la cantidad de orbitales atómicos p combinados para construir los orbitales híbridos, y no la cantidad de electrones que ocupan cada orbital.
Cada uno de los cuatro orbitales equivalente  tiene dos lóbulos de diferentes fase igual que un orbital p pero uno de los lóbulos es mayor que el otro. Los cuatro lóbulos mayores están orientados hacia los cuatro vértices de un tetraedro. Los orbitales híbridos tiene así configuraciones acentuadamente direccionales, de modo que cada uno sobre sale mucho más a lo largo del eje que el orbital p del que procede.
tiene dos lóbulos de diferentes fase igual que un orbital p pero uno de los lóbulos es mayor que el otro. Los cuatro lóbulos mayores están orientados hacia los cuatro vértices de un tetraedro. Los orbitales híbridos tiene así configuraciones acentuadamente direccionales, de modo que cada uno sobre sale mucho más a lo largo del eje que el orbital p del que procede.
 tiene dos lóbulos de diferentes fase igual que un orbital p pero uno de los lóbulos es mayor que el otro. Los cuatro lóbulos mayores están orientados hacia los cuatro vértices de un tetraedro. Los orbitales híbridos tiene así configuraciones acentuadamente direccionales, de modo que cada uno sobre sale mucho más a lo largo del eje que el orbital p del que procede.
tiene dos lóbulos de diferentes fase igual que un orbital p pero uno de los lóbulos es mayor que el otro. Los cuatro lóbulos mayores están orientados hacia los cuatro vértices de un tetraedro. Los orbitales híbridos tiene así configuraciones acentuadamente direccionales, de modo que cada uno sobre sale mucho más a lo largo del eje que el orbital p del que procede.
Los electrones compartidos en un enlace covalente formado con orbitales híbridos direccionales pasan la mayor parte de su tiempo en la región internuclear, como resultado los enlaces covalentes hechos de orbitales  son frecuentemente muy fuertes. De hecho la energía liberada en formar los cuatro enlaces
son frecuentemente muy fuertes. De hecho la energía liberada en formar los cuatro enlaces en el metano
en el metano  compensa la energía requerida para producir el estado excitado del carbono.
compensa la energía requerida para producir el estado excitado del carbono.
 son frecuentemente muy fuertes. De hecho la energía liberada en formar los cuatro enlaces
son frecuentemente muy fuertes. De hecho la energía liberada en formar los cuatro enlaces en el metano
en el metano  compensa la energía requerida para producir el estado excitado del carbono.
compensa la energía requerida para producir el estado excitado del carbono.
En el caso del metano, el carbono adoptaría una hibridación  , resultante de la combinación de un orbital s y tres p, con lo lóbulos principales dirigidos según los vértices de un tetraedro. Los cuatro enlaces sigma
, resultante de la combinación de un orbital s y tres p, con lo lóbulos principales dirigidos según los vértices de un tetraedro. Los cuatro enlaces sigma  del metano se formarían por solapamiento de orbitales híbridos
del metano se formarían por solapamiento de orbitales híbridos  con orbitales 1s del hidrógeno.
con orbitales 1s del hidrógeno.
 , resultante de la combinación de un orbital s y tres p, con lo lóbulos principales dirigidos según los vértices de un tetraedro. Los cuatro enlaces sigma
, resultante de la combinación de un orbital s y tres p, con lo lóbulos principales dirigidos según los vértices de un tetraedro. Los cuatro enlaces sigma  del metano se formarían por solapamiento de orbitales híbridos
del metano se formarían por solapamiento de orbitales híbridos  con orbitales 1s del hidrógeno.
con orbitales 1s del hidrógeno.
La misma clase de hibridación  que describe los enlaces del carbono en la molécula metano tetraédrico describe los enlaces del nitrógeno en la molécula piramidal del amonio, el oxígeno en la molécula de agua, y en todos aquellos átomos que la teoría VSEPR predice por tener una ordenación tetraédrico.
que describe los enlaces del carbono en la molécula metano tetraédrico describe los enlaces del nitrógeno en la molécula piramidal del amonio, el oxígeno en la molécula de agua, y en todos aquellos átomos que la teoría VSEPR predice por tener una ordenación tetraédrico.
Enlaces pi
 que describe los enlaces del carbono en la molécula metano tetraédrico describe los enlaces del nitrógeno en la molécula piramidal del amonio, el oxígeno en la molécula de agua, y en todos aquellos átomos que la teoría VSEPR predice por tener una ordenación tetraédrico.
que describe los enlaces del carbono en la molécula metano tetraédrico describe los enlaces del nitrógeno en la molécula piramidal del amonio, el oxígeno en la molécula de agua, y en todos aquellos átomos que la teoría VSEPR predice por tener una ordenación tetraédrico.Enlaces pi

Orbitales electrónicos atómico y molecular, mostrando un enlace Pi al extremo inferior derecho de la image
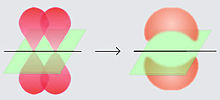
Los enlaces pi (enlaces π) son enlaces químicos covalentes donde dos lóbulos de un orbital involucrado en el enlace solapan con dos lóbulos del otro orbital involucrado. Estos orbitales comparten unplano nodal que pasa a través de los núcleosinvolucrados.
La letra griega π en su nombre se refiere a losorbitales p, dado que la simetría de los orbitales de los enlaces pi es la misma de la de los orbitales p. Generalmente, los orbitales p están involucrados en este tipo de enlace. Se asume que los orbitales d también participan en el enlace pi, pero esto no es necesariamente el caso en la realidad, aunque el concepto de enlace por medio de orbitales d explica bien la hipervalencia.
Los enlaces pi son generalmente más débiles si eso debe de ser que los enlaces sigma, porque su densidad electrónica negativamente cargada está más lejos de la carga positiva del núcleo atómico, lo que requiere más energía. Desde la perspectiva de la mecánica cuántica, la debilidad del enlace se explica por el traslape significativamente menor entre los componentes de los orbitales p, debido a la orientación paralela.
Aunque los enlaces pi por sí mismos son más débiles que un enlace sigma, los enlaces pi son componentes frecuentes de los enlaces múltiples, junto con los enlaces sigma. La combinación de enlace pi y enlace sigma es más fuerte que cualquiera de los enlaces por sí solo. El aumento de la fuerza de un enlace múltiple comparado con un enlace simple (enlace sigma) está indicado de varias formas, pero la más evidente es la contracción de la longitud de enlace. Por ejemplo, en química orgánica, la longitud de enlace carbono-carbono en el etano es (154 pm), etileno (133 pm) y acetileno (120 pm).
Además del enlace sigma, un par de átomos conectados por un enlace doble, enlace triple,enlace cuádruple o enlace quíntuple pueden tener uno, dos, tres o cuatro enlaces pi, respectivamente. Los enlaces pi resultan del traslape de orbitales atómicos que tienen dos áreas de traslape. Los enlaces pi son más difusos que los enlaces sigma. Los electrones en los enlaces pi son referidos algunas veces como electrones pi. Los fragmentos moleculares unidos por un enlace pi no pueden rotar libremente alrededor del enlace sin la ruptura del enlace pi, porque la rotación involucra la destrucción de la orientación paralela de los orbitales p constituyentes.

No hay comentarios.:
Publicar un comentario
Nota: sólo los miembros de este blog pueden publicar comentarios.